Contenuti
malattia di Creutzfeldt-Jakob
Che cos'è ?
La malattia di Creutzfeldt-Jakob è una delle malattie da prioni. Si tratta di malattie rare caratterizzate da degenerazione del sistema nervoso centrale e sono anche chiamate encefalopatie spongiformi trasmissibili subacute (TSE). Sono causati dall'accumulo nel cervello di una proteina normale ma poco conformata, la proteina prionica (1). Sfortunatamente, la malattia di Creutzfeldt-Jakob è caratterizzata da un decorso rapido e fatale, nonché dall'assenza di trattamento. Ci sono da 100 a 150 casi ogni anno in Francia (2).
Sintomi
La malattia spesso inizia con disturbi aspecifici come l'insonnia o l'ansia. A poco a poco, si manifestano disturbi della memoria, dell'orientamento e del linguaggio. Si manifesta quindi con disturbi psichiatrici e atassia cerebellare (instabilità in posizione eretta e durante il cammino che è accompagnata da un barcollamento simile a quello dell'ubriachezza). Sono inoltre presenti lesioni tipiche del sistema nervoso centrale (placche floride, depositi amiloidi di PrPres circondati da vacuoli).
Sono colpiti entrambi i sessi, ma con un'alta frequenza nei giovani adulti.
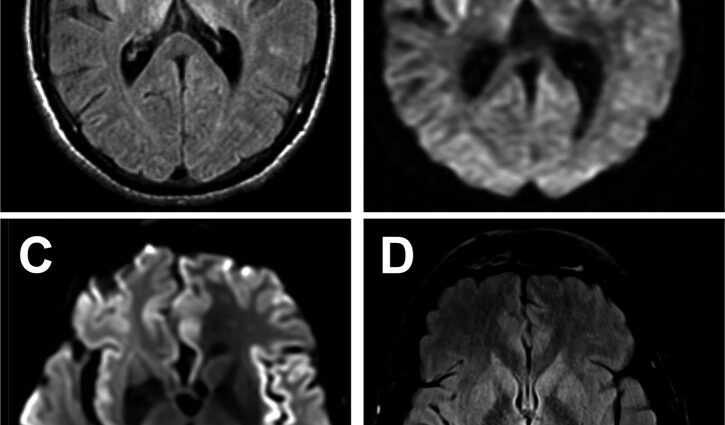
Sfortunatamente, non esiste un test diagnostico affidabile. Un elettroencefalogramma (EEG) può identificare disturbi relativamente specifici dell'attività cerebrale. La risonanza magnetica rivela anomalie specifiche in alcune regioni del cervello (gangli della base, corteccia) per le quali esistono poche diagnosi differenziali.
Se tutti questi elementi clinici e paraclinici possono consentire di porre una diagnosi di malattia di Creutzfeldt-Jakob, questa è solo una diagnosi probabile: infatti, solo l'esame del tessuto cerebrale, effettuato più spesso dopo la morte, consente di confermare la diagnosi.
Le origini della malattia
La malattia di Creutzfeld-Jakob è l'unica malattia umana che può essere di causa genetica (dovuta a una mutazione nel gene che codifica per la proteina prionica, la mutazione E200K è la più comune), causa infettiva (secondaria alla contaminazione) o di forma sporadica (di occorrenza casuale, senza mutazione o esposizione a un prione esogeno trovato).
Tuttavia, la forma sporadica è la più comune: rappresenta l'85% di tutte le encefalopatie spongiformi trasmissibili subacute (EST) diagnosticate ogni anno. In questo caso, la malattia di solito compare dopo i 60 anni e progredisce in un periodo di circa 6 mesi. Quando la malattia è genetica o infettiva, i sintomi sono precoci e progrediscono più lentamente. Nelle forme infettive, il periodo di incubazione può essere estremamente lungo e superare i 50 anni.
Fattori di rischio
La proteina prionica (PrPc) è una proteina fisiologica che si trova in maniera molto conservata in molte specie. Nei neuroni del cervello, la proteina prionica può diventare patogena cambiando la sua conformazione tridimensionale: si ripiega su se stessa molto strettamente, il che la rende idrofoba, scarsamente solubile e resistente alla degradazione. Viene quindi chiamata proteina prionica "scrapie" (PrPsc). Le PrPsc si aggregano tra loro e formano depositi che si moltiplicano all'interno e all'esterno delle cellule cerebrali, interrompendone la funzione e i meccanismi di sopravvivenza.
In questa forma anormale, la proteina prionica è anche in grado di trasmettere la sua anomalia conformazionale: a contatto con una PrPsc, una proteina prionica normale adotta a sua volta una conformazione anormale. Questo è l'effetto domino.
Il rischio di trasmissione tra individui
La trasmissione interindividuale delle malattie da prioni è possibile con il trapianto di tessuto o in seguito alla somministrazione di ormoni della crescita. I tessuti più rischiosi provengono dal sistema nervoso centrale e dall'occhio. In misura minore, anche il liquido cerebrospinale, il sangue e alcuni organi (reni, polmoni, ecc.) possono trasmettere il prione anomalo.
Il rischio del cibo
La trasmissione di un prione dal bestiame all'uomo attraverso il consumo di cibo contaminato è stata sospettata nel 1996, durante la drammatica crisi della “mucca pazza”. Da diversi anni, un'epidemia di encefalopatia spongiforme bovina (BSE) colpisce gli allevamenti nel Regno Unito3. La diffusione di questa malattia da prioni, che colpiva decine di migliaia di animali ogni anno, era senza dubbio dovuta all'uso di farine animali, prodotte da carcasse e non sufficientemente decontaminate. La sua origine, tuttavia, rimane dibattuta.
Prevenzione e trattamento
Oggi non esiste un trattamento specifico per le malattie da prioni. Gli unici farmaci che possono essere prescritti sono quelli che possono alleviare o limitare i vari sintomi della malattia. Il supporto medico, sociale e psicologico è offerto ai pazienti e alle loro famiglie dall'Unità nazionale di supporto CJD. È auspicabile la ricerca di farmaci volti a prevenire la conversione della PrPc, favorendo l'eliminazione delle forme anomale della proteina e limitandone la diffusione. Un vantaggio interessante si rivolge a PDK1, uno dei mediatori cellulari coinvolti durante l'infezione. La sua inibizione permetterebbe sia di inibire il fenomeno di conversione favorendo il clivaggio di PrPc, sia di attenuare le conseguenze della sua replicazione sulla sopravvivenza dei neuroni.